La thérapie cellulaire CAR-NK : un changement possible dans le traitement du cancer ?
La thérapie à base de cellules NK à récepteur d’antigène chimérique (CAR) a récemment fait l’objet d’une attention particulière en tant que nouvel outil thérapeutique contre le cancer. Les cellules NK sont des cellules tueuses naturelles qui sont des lymphocytes innés, permettant une réponse plus rapide aux pathogènes avant que le système immunitaire adaptatif ne soit activé. Par rapport aux cellules T, les cellules NK sont reconnues comme une meilleure base CAR, avec une efficacité plus forte et une application clinique plus sûre, en raison de leurs récepteurs anti-tumoraux naturels et de leur compatibilité allogénique. En outre, la thérapie cellulaire CAR-NK, avec son potentiel « prêt à l’emploi », catalysera une nouvelle révolution dans l’immunothérapie du cancer. Dans cet article, Alcimed met en lumière les principaux avantages de la thérapie cellulaire CAR-NK et identifie les principaux défis qu’elle doit relever.
Qu’est-ce que la thérapie cellulaire CAR-NK ?
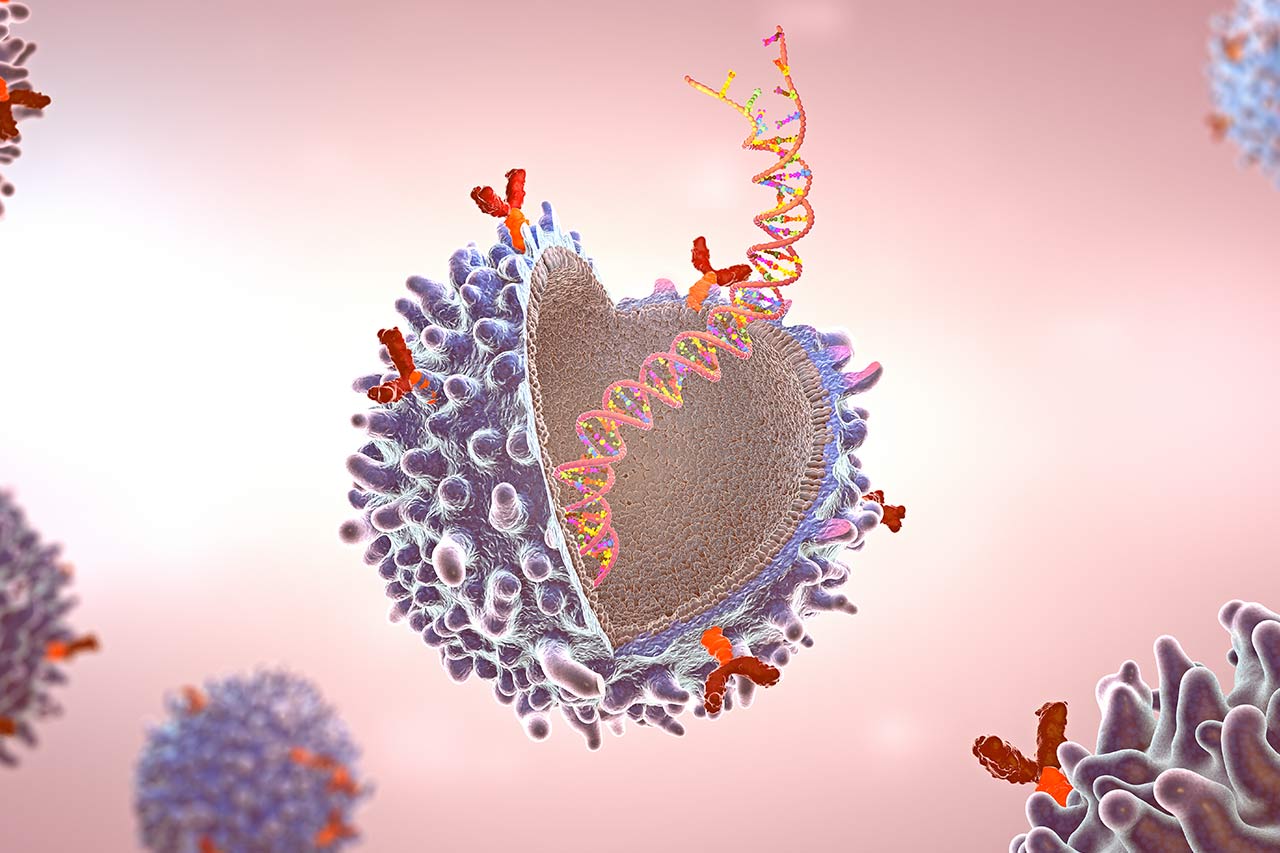
La thérapie cellulaire CAR-NK est une nouvelle stratégie d’immunothérapie qui utilise des cellules NK génétiquement modifiées pour cibler un cancer spécifique, une tumeur liquide ou solide. Les cellules NK peuvent être initialement acquises à partir de diverses sources, notamment des patients, des donneurs sains et des laboratoires (par exemple, des cellules souches pluripotentes induites-iPSC).
Le code génétique des récepteurs CAR spécifiques de la tumeur cible sera incorporé dans le génome des cellules NK, puis affiché à la surface de la cellule. Les cellules CAR-NK sont enrichies dans des conditions de culture favorables avant d’être transfusées aux patients. Une fois dans la circulation sanguine, les récepteurs CAR fonctionneront comme un « navigateur GPS » pour les cellules NK locales en se liant à la protéine de l’antigène cible sur la tumeur. Les cellules NK libèrent ensuite des protéines formant des pores qui provoquent la destruction des cellules cancéreuses.
Pourquoi la thérapie cellulaire CAR-NK pourrait-elle aller plus loin que la thérapie cellulaire CAR-T ?
Les cellules NK sont proposées comme base CAR supérieure en raison de leurs caractéristiques physiologiques uniques. En remplaçant la base de la thérapie CAR par des cellules NK, il est possible de résoudre de manière remarquable les problèmes de restriction autologue et d’effets indésirables graves causés par la thérapie par cellules CAR-T.
Des cellules NK au potentiel « prêt à l’emploi »
Les cellules NK ne sont pas limitées par le contexte autologue, ce qui signifie que les patients peuvent recevoir des cellules NK allogéniques provenant de diverses sources sans craindre la maladie du greffon contre l’hôte (GVHD). En effet, les cellules NK n’ont pas besoin de correspondre à l’antigène leucocytaire humain (HLA) comme les cellules T. Cette caractéristique unique ouvre la voie à une nouvelle génération de cellules NK. Cette caractéristique unique permet de rationaliser le processus de fabrication de produits CAR-NK spécifiques à l’avance et d’augmenter l’évolutivité sans adaptation aux patients individuels. En outre, les cellules NK obtenues à partir d’iPSC constituent une population homogène par rapport à celles provenant d’autres sources, ce qui garantit la standardisation en tant que produit « prêt à l’emploi ».
Des applications cliniques plus sûres pour la thérapie cellulaire CAR-NK
Les cellules NK ont une durée de vie plus courte que les autres lymphocytes cytotoxiques. Cette caractéristique peut considérablement atténuer le risque d’effet sur la cible/hors de la tumeur, qui est un problème majeur dans la thérapie cellulaire CAR-T en raison des cellules T à mémoire. Sans rester dans la circulation sanguine à long terme, les cellules CAR-NK restantes auront moins de chances d’affecter les cellules saines ciblées par CAR.
En outre, les cellules NK activées sécrètent une multitude de cytokines qui sont très différentes de celles des cellules T. Ces dernières ont tendance à libérer diverses substances pro-inflammatoires, ce qui entraîne un syndrome de libération de cytokines dans les applications cliniques CAR-T. Un excès de cytokines entraînerait une diminution de la production de cellules CAR-NK, ce qui pourrait endommager les organes et même entraîner la mort. Heureusement, les cellules NK activées libèrent généralement de l’IFN-gamma et du GM-CSF, qui ne contribuent pas de manière significative à la tempête de cytokines.
Une efficacité accrue dans le ciblage des cellules cancéreuses
Les cellules NK expriment naturellement une large gamme de récepteurs anti-tumoraux. Ces récepteurs sont associés aux ligands induits par le stress qui sont généralement identifiés à la surface des cellules cancéreuses. Plutôt que de s’appuyer uniquement sur les récepteurs cibles CAR, comme dans le cas de la thérapie cellulaire CAR-T, le renforcement de la liaison de ces ligands tumoraux avec les récepteurs anti-tumoraux naturels rend la thérapie cellulaire CAR-NK encore plus efficace contre les cellules cancéreuses malignes qui présentent une grande hétérogénéité.
Quelles sont les limites du développement de la thérapie cellulaire CAR-NK ?
Bien que les avantages de la thérapie cellulaire CAR-NK soient reconnus, ces avantages pourraient également donner lieu à deux défis qui freinent les applications cliniques.
La cryoconservation affaiblit l’efficacité anti-tumorale
Pour fabriquer un produit « prêt à l’emploi », on utilise couramment la cryoconservation pour conserver les cellules CAR-NK intactes à très basse température. Cependant, les cellules NK sont très sensibles à la congélation et à la décongélation par rapport aux autres lymphocytes, ce qui peut avoir un impact négatif sur l’efficacité de la destruction après la récupération du froid. GC cell (Corée du Sud), l’un des leaders commerciaux de la thérapie cellulaire CAR-NK, a découvert une composition particulière de milieu de congélation qui pourrait améliorer la préservation de la viabilité et de la fonction des cellules NK. Cette technologie de congélation avancée a considérablement accéléré la préparation des cellules CAR-NK en tant que produits thérapeutiques « prêts à l’emploi ».
La courte durée de vie réduit l’effet thérapeutique persistant contre les tumeurs invasives
En raison de leur courte durée de vie, les cellules CAR-NK s’épuisent progressivement après avoir exercé leurs activités de destruction des cancers. Une faible persistance pourrait conduire à une élimination incomplète des cellules cancéreuses, en particulier pour les tumeurs invasives. En outre, les cellules NK ne produisent pas de cellules mémoires capables de rester dans la circulation sanguine. Par conséquent, une régression de la tumeur pourrait se produire, ce qui rendrait le traitement inefficace. Les chercheurs ont essayé différentes stratégies pour améliorer la persistance in vivo des cellules CAR-NK, y compris le dosage multiple des cellules NK dérivées des iPSC, la co-expression de déclencheurs de survie cellulaire (sIL-15 ou mbIL-15) sur la construction CAR et la modification de la structure de l’épine dorsale CAR pour empêcher la suractivation in vitro.
Quels sont les principaux acteurs industriels de la thérapie cellulaire CAR-NK ?
Nkarta Therapeutics a reçu un investissement de série B de 114 millions de dollars pour la construction de pipelines de recherche sur les thérapies CAR-NK et d’un site de production, dont deux pipelines sont entrés en phase d’essai clinique. Kiadis Pharm a également développé plusieurs programmes de recherche sur la thérapie CAR-NK, axés sur le traitement des tumeurs liquides et solides, dont l’un est entré en phase II d’essai clinique.
La thérapie cellulaire CAR-NK a le potentiel de provoquer un changement de paradigme dans le traitement du cancer. Mieux relever les défis de la thérapie cellulaire CAR-NK serait un facteur déterminant pour devenir un acteur de premier plan dans le domaine de l’immunothérapie. Chez Alcimed, nous ne cessons d’explorer les limites de la connaissance en matière de thérapie cellulaire CAR-NK et nous recherchons les solutions les plus récentes pour faire avancer les applications cliniques, n’hésitez pas à nous contacter !
À propos de l’auteur,
Xianjin, consultant au sein de l’équipe Santé d’Alcimed en Asie-Pacifique