Was sind Antikörper-Wirkstoff-Konjugate?
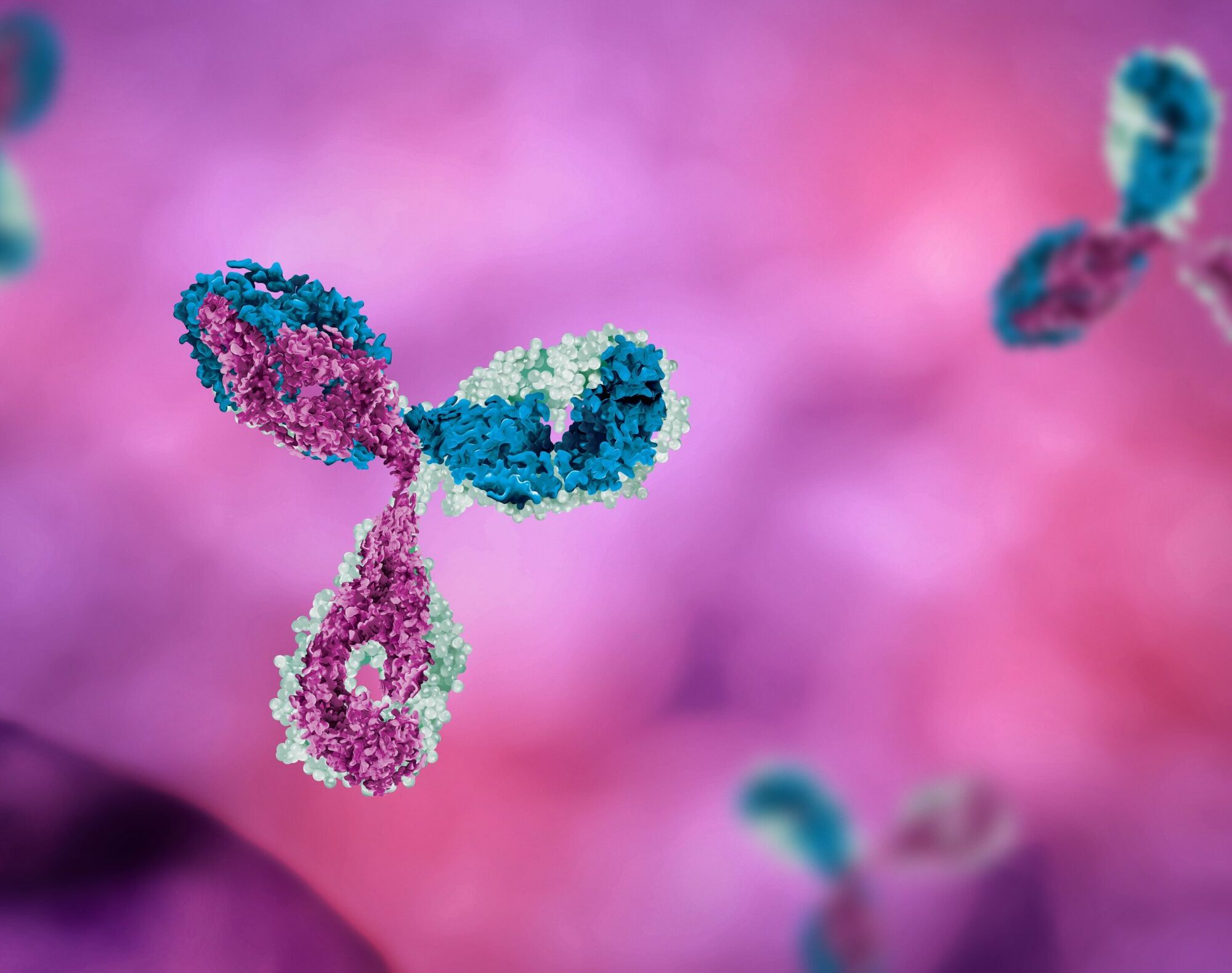
Antikörper-Wirkstoff-Konjugate (ADCs) sind eine zielgerichtete Therapie, die in der Krebsbehandlung eingesetzt wird und einen Antikörper, einen zytotoxischen Wirkstoff und ein Bindungsmolekül enthält. Die Antikörperkomponente erkennt Krebszellen spezifisch, indem sie an deren Oberflächenantigene bindet, und gibt das zytotoxische Medikament direkt an die Krebszellen ab, während gesunde Zellen so wenig wie möglich geschädigt werden. ADCs bieten Vorteile wie verbesserte Ergebnisse, geringere Nebenwirkungen, die Möglichkeit zur Überwindung von Resistenzen und die gezielte Abgabe von Medikamenten.
Antikörper-Wirkstoff-Konjugate (ADCs) stellen einen eleganten Mechanismus dar, der die Stärke von Antikörpern und zytotoxischen Wirkstoffen kombiniert, um Krebszellen gezielt zu bekämpfen. Mit ihren drei Hauptkomponenten ebnen ADCs den Weg für einen präziseren und wirksameren Ansatz in der Krebstherapie.
Wie wirken ADCs in der Krebstherapie?
Schritt 1: ADC bindet an die Oberfläche der Krebszelle
ADCs verwenden zunächst monoklonale Antikörper, die speziell dafür entwickelt wurden, bestimmte Antigene auf der Oberfläche von Krebszellen zu erkennen und an diese zu binden. Diese gezielte Erkennung ermöglicht die selektive Abgabe der therapeutischen Nutzlast an die Krebszellen, wodurch gesunde Zellen vor unnötiger Schädigung bewahrt werden. Jedes ADC ist auf das Antigenprofil der zu behandelnden Krebsart zugeschnitten, wie z.B. die spezifische Ausrichtung auf HER2 bei HER2-positivem Brustkrebs.
Schritt 2: ADC wird in die Krebszelle eingeschleust
Sobald das ADC an die Oberfläche der Krebszelle gebunden ist, wird es durch rezeptorvermittelte Endozytose in die Krebszelle aufgenommen. Der aus Antikörper und Antigen gebildete Komplex begibt sich auf die Reise in intrazelluläre Kompartimente wie Endosomen und Lysosomen und legt damit den Grundstein für folgende Schritte.
Schritt 3: Freisetzung des Medikaments in der Krebszelle
In diesen intrazellulären Kompartimenten findet ein entscheidender Prozess statt. Das Linkermolekül, das als Brücke zwischen dem Antikörper und dem zytotoxischen Wirkstoff dient, wird enzymatisch oder chemisch gespalten. Durch diese präzise Spaltung, die durch spezifische Faktoren der intrazellulären Umgebung ausgelöst wird, wird der zytotoxische Wirkstoff von seinem Antikörperträger befreit. Das ausgeklügelte Design des Linkers sorgt für eine kontrollierte Freisetzung des Medikaments innerhalb der Krebszelle und schützt gesundes Gewebe vor unnötiger Belastung.
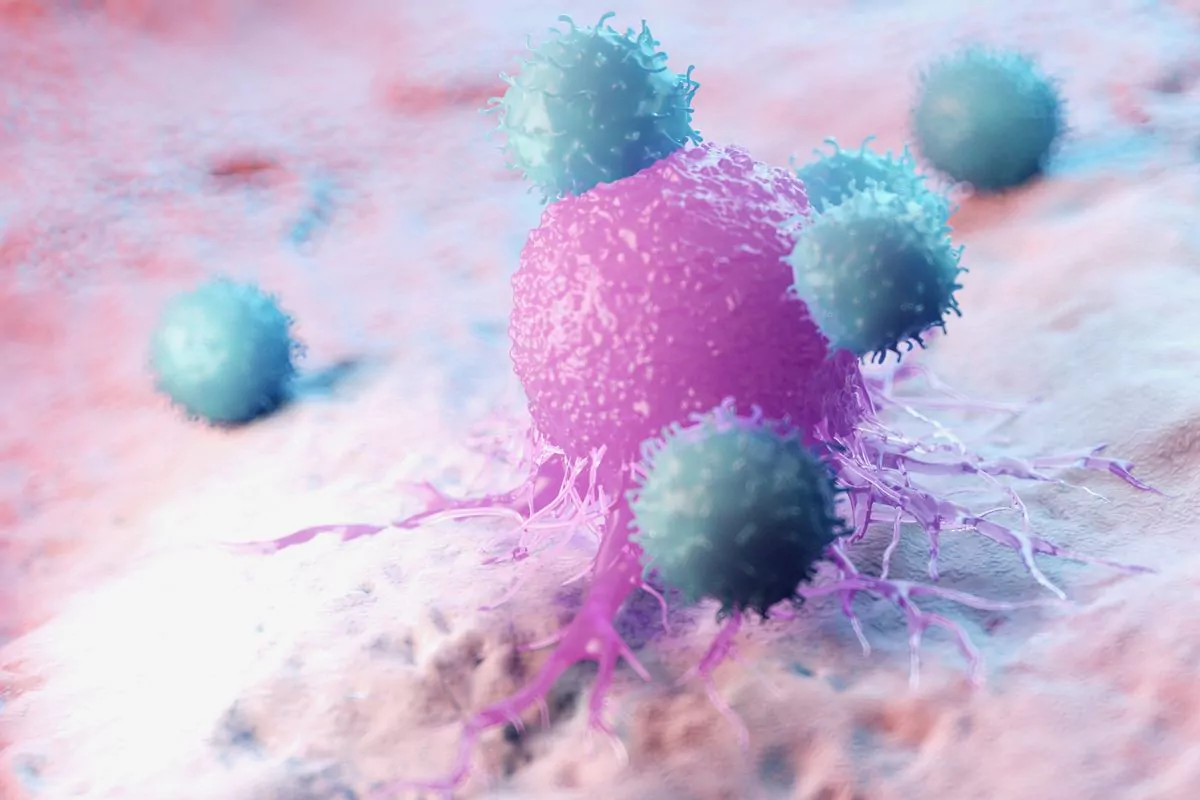
Schritt 4: Wirkstoff tritt in Aktion und führt zum Absterben der Krebszellen
Sobald der zytotoxische Wirkstoff freigesetzt ist, tritt er mit bemerkenswerter Effizienz in Aktion. Er unterbricht entscheidende zelluläre Prozesse wie die DNA-Replikation oder den Aufbau von Mikrotubuli und hemmt so die Fähigkeit der Krebszelle, sich zu teilen und zu wachsen. Schon in geringen Konzentrationen ist das zytotoxische Medikament hochwirksam, da es die Krebszellen zum Absterben bringt und so den Therapieerfolg fördert.
Das komplexe Zusammenspiel von Antikörper, Linker und zytotoxischem Wirkstoff in ADCs stellt einen Durchbruch in der Krebstherapie dar. Durch die Nutzung der zielgerichteten Fähigkeiten von Antikörpern bieten ADCs einen maßgeschneiderten Ansatz, der wirksame Medikamente direkt an Krebszellen abgibt, während gesunde Zellen geschont werden. Dieses präzise Targeting soll die Wirksamkeit der Behandlung maximieren und gleichzeitig die mit der herkömmlichen Chemotherapie verbundenen Nebenwirkungen minimieren.
Antikörper-Wirkstoff-Konjugate stehen in der Krebstherapie noch vor mehreren Herausforderungen
Eine Herausforderung ist die mögliche Entwicklung von Resistenzen. Krebszellen können Mechanismen entwickeln, um ADCs zu umgehen oder zu eliminieren, wodurch ihre Wirksamkeit mit der Zeit abnimmt. Darüber hinaus kann die Heterogenität von Tumoren, bei denen verschiedene Krebszellen unterschiedliche Mengen von Antigenen exprimieren, die Wirksamkeit von ADCs einschränken, die auf spezifische Antigene abzielen.
Sicherheitsbedenken ergeben sich auch aus der zytotoxischen Natur der Arzneimittelkomponente. Eine unzureichende Selektivität kann zu Off-Target-Effekten führen, bei denen gesunde Zellen in Mitleidenschaft gezogen werden, was unerwünschte Reaktionen zur Folge hat. Darüber hinaus kann die Toxizität des Arzneimittels die maximal verabreichbare Dosis begrenzen, was die Wirksamkeit der Behandlung auf lokaler Ebene beeinträchtigen kann.
Beispiele für wichtige Antikörper-Wirkstoff-Konjugate in der Krebstherapie
Ado-Trastuzumab Emtansin (Kadcyla), Brentuximab Vedotin (Adcetris), Polatuzumab Vedotin (Polivy) und Trastuzumab Deruxtecan (Enhertu) sind wichtige Beispiele für Antikörper-Wirkstoff-Konjugate (ADCs), die in der Krebstherapie eine bedeutende Rolle spielen.
Das von Genentech/Roche entwickelte Kadcyla richtet sich gegen HER2 und hat sich bei der Behandlung von HER2-positivem Brustkrebs als wirksam erwiesen. Durch die präzise Ausrichtung auf HER2 bietet Kadcyla einen zielgerichteten therapeutischen Ansatz, der auf diesen spezifischen Brustkrebssubtyp zugeschnitten ist, die Behandlungsergebnisse verbessert und die Lebensqualität der Patienten erhöht.
Seattle Genetics/Seagen bringt Adcetris auf den Markt, ein auf CD30 abzielendes ADC. Adcetris hat seine Wirksamkeit beim Hodgkin-Lymphom, beim systemischen anaplastischen großzelligen Lymphom und bei anderen CD30-positiven Lymphomen unter Beweis gestellt. Der bemerkenswerte Erfolg in diesen Indikationen hat Patienten mit diesen schwierigen Erkrankungen Hoffnung gegeben.
Polivy von Genentech/Roche ist auf CD79b gerichtet und stellt eine vielversprechende Behandlungsoption für Patienten mit diffusem großzelligem B-Zell-Lymphom dar. Durch die spezifische Bindung an CD79b gibt Polivy seine zytotoxische Nutzlast direkt an die Krebszellen ab und soll so das Fortschreiten der Krankheit stoppen und die Behandlungsergebnisse der Patienten verbessern.
Daiichi Sankyo und AstraZeneca haben gemeinsam Enhertu entwickelt, ein ADC, das auf HER2 abzielt. Enhertu hat sowohl bei HER2-positivem Brustkrebs als auch bei HER2-positivem Magenkrebs eine beeindruckende Wirksamkeit gezeigt. Durch die gezielte Wirkung auf HER2 gibt Enhertu ein starkes zytotoxisches Medikament direkt an die Krebszellen ab und gibt Patienten, die gegen diese Krebsarten kämpfen, neue Hoffnung.
Zusammenfassend lässt sich sagen, dass der Bereich der Antikörper-Wirkstoff-Konjugate (ADCs) durch Dynamik gekennzeichnet ist. Trotz anfänglicher Rückschläge und Herausforderungen nimmt die Zahl der zugelassenen und in der klinischen Erprobung befindlichen ADCs stetig zu. Es wird erwartet, dass sich dieses Wachstum in den nächsten zehn Jahren deutlich beschleunigen wird. Bei Alcimed halten wir Sie über die neuesten Entwicklungen auf diesem spannenden Gebiet auf dem Laufenden. Wenn Sie ein Projekt in diesem Bereich haben, zögern Sie nicht, unser Team zu kontaktieren!
Über den Autor,
Volker, Great Explorer Oncology in Alcimeds Life Sciences Team in Deutschland